Полный доступ для зарегистрированных пользователей
Полный доступ для зарегистрированных пользователей
О.К. Нетребенко
ПИТАНИЕ В МЛАДЕНЧЕСТВЕ: ДОРОГА К ДОЛГОЙ ЖИЗНИ ИЛИ К РАННЕЙ БОЛЕЗНЕННОЙ СТАРОСТИ?
ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» МЗ РФ, Институт питания Нестле, Москва, РФ
В обзоре рассматриваются основные теории старения человека и связь процессов старения человека с характером питания в период младенчества. Современные данные показывают тесную связь характера вскармливания младенца с развитием основных гормональных траекторий и с активацией сигнальных путей, приводящих к неблагоприятным для здоровья человека последствиям.
Ключевые слова: питание младенцев, процессы старения организма, свободно-радикальное окисление, повреждение ДНК, теломеры, хроническое воспаление, протеинкиназа mTOR, инсулин, инсулиноподобный фактор роста-1, сиртуины.
Цит.: О.К. Нетребенко. Питание в младенчестве: дорога к долгой жизни или к ранней болезненной старости? Педиатрия. 2017; 96 (1): 67–74.
Контактная информация:
Нетребенко Ольга Константиновна — д.м.н., проф. каф. госпитальной педиатрии № 1 ФГБОУ ВО
РНИМУ им. Н.И. Пирогова МЗ РФ, руководитель
Института питания Нестле (Россия)
Адрес: Россия, 117997, г. Москва, ул. Островитянова, 1
Тел.: (495) 725-70-67,
E«mail: olga.netrebenko@ru.nestle.com
Статья поступила 10.11.16,
принята к печати 20.01.17.
Старение человека означает прогрессивное снижение физиологических функций организма, которое приводит к развитию заболеваний и смерти. Это глобальный всеобъемлющий процесс, в основе которого лежат различные механизмы, приводящие к развитию хронических неинфекционных заболеваний, нарушению когнитивных функций, снижению физической и социальной активности. Исследования продолжительности жизни близнецов показали, что только около 20–30% продолжительности жизни связано с генетическими факторами, остальные 70–80% — с факторами окружающей среды, питанием, образом жизни. То есть продолжительная, безболезненная старость — это не генетический подарок, а во многом последствия отношения человека к своему здоровью и образу жизни [1]. И, в конечном итоге, люди умирают не от старости, а от заболеваний, сопровождающих процессы старения.
К этим заболеваниям относят сердечно-сосудистые нарушения (артериальная гипертензия, инфаркт, инсульт), метаболические расстройства (диабет, ожирение), нарушение иммунных функций с развитием бронхиальной астмы, тяжелых аллергических заболеваний, нейродегенеративные изменения (болезнь Альцгеймера, Паркинсона) и др. В последнее время наиболее активно ведутся исследования процессов старения организма и факторов, влияющих на эти процессы.
Механизмы развития процессов старения.
В настоящее время рассматриваются несколько теорий старения человека. Теория свободно-радикального окисления (СРО) (теория повреждения клеток и молекул) говорит о том, что в процессе старения постепенно нарушается механизм транспорта электронов в митохондриях, что влечет за собой повышение продукции супероксида и других радикалов. Накопление свободных радикалов в клетках и тканях приводит к окислительному повреждению органелл, липидов клеточных мембран и других структурных компонентов, формируя особый клеточный фенотип «стареющая клетка» (СК). СК теряет способность к репликации и начинает продуцировать провоспалительные цитокины. Процесс хронического воспаления, связанный с аккумуляцией СК и/или нарушением функции иммунной системы, определяет фенотип стареющего организма. Эта теория получила широкое распространение, однако в настоящее время нет убедительных доказательств того, что использование средств, снижающих процессы СРО, предотвращает процессы старения и продлевает жизнь человека [2]. По-видимому, увеличение процессов СРО является одним из промежуточных механизмов развития процесса старения.
Теория повреждения ДНК близка к теории СРО. Предполагается, что в процессах СРО или под действием других повреждающих факторов происходит нарушение структуры (повреждение) ДНК с последующим накоплением поврежденной ДНК, что влечет за собой нарушение стабильности генома [3]. Хотя ДНК не единственный фактор, изменяющийся в процессах старения, учитывая огромную роль этой макромолекулы в процессах регуляции всех клеточных структур, было проведено большое количество исследований процессов повреждения ДНК при старении организма.
Следует отметить, что старение это длительный процесс, на который влияет множество факторов, таких как образ жизни, питание, радиация и генотоксичные вещества, которые повреждают и аккумулируют поврежденную ДНК и ассоциируются с процессами старения организма. Методологические факторы могут влиять на результаты исследований повреждения ДНК, так как измерение повреждения ДНК может отражать нарушения восстановительной способности клетки, кроме того, процесс старения разных тканей и органов проходит неодинаково. Единственный мета-анализ исследований по влиянию повреждения ДНК на процессы старения показал наличие связи между повреждением ДНК и старением организма, однако по-прежнему остается неясной причинно-следственная связь: повреждение ДНК увеличивает процесс старения или процесс старения сопровождается повреждением ДНК [4].
В экспериментальных условиях было показано, что нарушение питания матери во время беременности с последующим быстрым постнатальным ростом потомства вызывает повреждение ДНК, окислительный стресс и снижение антиоксидантной защиты [5].
К теории повреждения ДНК близка теория предела Хейфлика (стареющие часы) или теория теломеров.
Теломеры — это концевые участки хромосом соматических клеток, которые еще называют концевые «заклепки», так как они удерживают концы ДНК от процессов «расплетания» и изнашивания. Каждое деление клеток или клеточная репликация укорачивает теломеры (молекулярные часы), и, когда они становятся совсем короткими, клетка теряет способность к репликации и становится СК [6]. Эту теорию создал и разработал Leonard Hayflick в 1961 г., который назвал ее «предел Хейфлика» и рассчитал, что максимальная продолжительность жизни человека составляет 120 лет, после чего теломеры становятся слишком короткими для деления и репликации клеток [7]. Структуру теломеров и их связь с болезнями человека активно изучали американские ученые группы Elizabeth Blackburn, которые в 2009 г. получили Нобелевскую премию за эту работу. Многочисленные последующие исследования показали укорочение теломер большинства соматических клеток в процессе старения. Более того, была выявлена тесная связь развития ряда тяжелых заболеваний, таких как рак, диабет, нейродегенеративные заболевания с укорочением теломер [8]. Таким образом, длина теломер предсказывает начало процесса репликативного старения. Когда теломеры становятся слишком короткими, они теряют свои функции и активируют повреждение ДНК за счет разрыва или «расплетания» волокон [9]. За этим процессом следует каскад сигналов, вызывающих апоптоз или перманентное прекращение деления клеток, что считается главным функциональным фактором старения. Появилось понятие «синдрома теломер», который совпадает с фенотипом стареющего организма человека, при котором на ранних этапах наблюдаются нарушения в тканях с быстрым делением (обновлением) клеток с симптомами потери волос, развитием парадонтоза, тромбоцитопении, гастроинтестинальных нарушений, увеличивается риск рака, непереносимость химиотерапии. Для тканей с медленным обновлением клеток характерны развитие синдромов эмфиземы, фиброза и цирроза печени, нарушение секреции инсулина, толерантности глюкозы, инсулинорезистентность, остеопороз. Таким образом, длина теломер является маркером процесса старения.
Исследования длины теломер у людей разных возрастных групп обнаружили влияние срока гестации, массы тела (МТ) при рождении, скорости роста на первом году жизни и других факторов. Так, по данным Smeets (2015), у молодых людей в возрасте 18–24 лет длина теломер была короче у родившихся недоношенными по сравнению с молодыми людьми, родившимися в срок, что, по мнению авторов, свидетельствует о начале процессов биологического старения [10]. В другой работе было выявлено влияние МТ при рождении. Исследование группы школьников в Бангладеш показало [11], что у детей, родившихся с малой МТ, длина теломер была меньше, чем у детей с нормальной МТ (рис. 1). Следует отметить, что не во всех исследованиях получены аналогичные данные, поэтому вопрос о длине теломер у недоношенных и маловесных детей остается спорным [12].
M. Guzzardi с сотрудниками [13] в 2011— 2013 гг. исследовали когорту людей (8760 человек), родившихся в 1934–1944 гг. в центральной городской клинике г. Хельсинки. Определение длины теломер у этой когорты проводилось в возрасте 70 лет. Было обнаружено, что у людей, родившихся от матерей с ожирением или избыточной МТ, длина теломер была короче по сравнению с группой людей, родившихся от здоровых матерей. Также длина теломер была короче у людей, у которых была высокая прибавка МТ за первый год жизни. Интересно отметить, что эти данные верны для лиц женского пола, в то время как у 70-летних мужчин достоверных отличий не выявлено.
Анализ 3 приведенных выше теорий показывает их близость и отсутствие противоречий между ними. Действительно, повреждение ДНК может быть следствием процессов СРО вне зависимости от их причины, с другой стороны, есть данные о влиянии СРО одновременно с повреждением ДНК на длину теломеров. Механизм действия СРО на длину теломеров связан с дисфункцией митохондрий и увеличением продукции свободных радикалов. В определенном смысле длина теломеров является сенсором функций митохондрий. Селективные антиоксиданты, нацеленные на митохондрии, способны снизить процесс СРО и прекратить укорочение теломер [14].
Теория хронического воспаления (inflammaging). Характерной чертой процесса старения является развитие хронического подострого воспалительного процесса [15]. Хронический провоспалительный статус (ХПС) появляется в процессе старения вне всякой связи с инфекци онным процессом

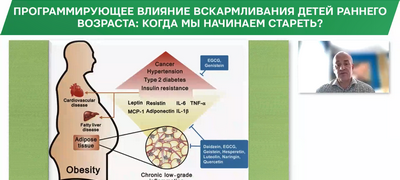
(«стерильное» воспаление), обозначаемое термином «inflammaging», и представляет собой достоверный фактор риска развития заболеваний и смертности людей пожилого возраста [16]. ХПС прогнозирует развитие нескольких «возрастных» заболеваний, включая диабет 2-го типа и его осложнения. Особый интерес представляют собой новые данные о микровоспалении в районе гипоталамуса, которое является фактором нарушения нейроэндокринной регуляции, развития метаболического синдрома (МС) и активизации процессов старения. Экспериментальные исследования показывают, что процесс микровоспаления увеличивает экспрессию сотен генов провоспалительных цитокинов, повышая уровень TNFα, интерлейкинов. В целом эти молекулярные провоспалительные изменения в гипоталамусе связаны с умеренной активацией ядерного фактора κβ, который формирует гипоталамическое микровоспаление (ГМ), которое в свою очередь нарушает центральную регуляцию энергетического баланса, гомеостаз глюкозы, артериальное давление и формирует основные признаки МС [17].
В экспериментальных исследованиях было продемонстрировано, что ГМ затрудняет нейрогенез в микроглии гипоталамуса, ускоряет нарушение когнитивных функций и процессы старения, сокращает продолжительность жизни. Тем не менее остается неясным вопрос, что именно является драйвером воспаления в гипоталамусе в процессах старения. Предполагается, что такие изменения, как ожирение, иммунная дисфункция вносят свой вклад в ГМ [16, 18].
Можно ли изменить провоспалительный статус у людей? В исследовании S. Meydani (2016), проведенном на взрослых здоровых добровольцах, было показано, что ограничение калорийности рациона на 25% от обычного потребления в течение 2 лет позволило значимо снизить основные маркеры воспаления, такие как С-реактивный белок, TNFα (соответственно на 40 и 50%) и др., в плазме крови у людей из группы ограниченной калорийности по сравнению с контрольной группой. Есть реальная возможность снизить активность микровоспаления в гипоталамусе. Экспериментальные исследования показывают, что ограничение рациона на ранних этапах развития (от рождения до введения прикорма) снижает активность ГМ и продлевает жизнь в лабораторных условиях [19].
Теория гиперфункции или mTOR теория. mTOR (mechanistic ранее mammalian target of rapamycin) — это протеинкиназа серин-треониновой специфичности, комплекс белковых молекул, вовлеченных в процессы роста, развития, метаболических нарушений (ожирение, МС) и, в конечном итоге, в процессы старения организма.
Все живые организмы обладают способностью реагировать на изменение достаточности и доступности ключевых нутриентов, необходимых для выживания. Адаптация клеток и тканей к изменению поступления нутриентов определяется комплексом молекул, регулирующих процессы анаболизма и катаболизма. В центре этой системы располагается комплекс mTOR сигнальных молекул, регулирующих процессы метаболизма. Протеинкиназа mTOR существует в виде 2 различных комплексов — mTORC1 и mTORC2. Они отличаются по своему расположению внутри клетки, чувствительностью к рапамицину (mTORC1 — более чувствителен) и передачей сигналов через различные белковые молекулы. Оба комплекса реагируют на поступление нутриентов. В состоянии высокого поступления нутриентов происходит активация mTOR, которая является сигналом к процессам клеточного роста, активной пролиферации и дифференциации [20].
Пути сигналов mTOR работают во всех живых организмах, начиная от дрожжей и кончая млекопитающими, однако у млекопитающих сигналы mTOR, помимо роста, связаны с развитием болезней, сопряженных с процессом старения [21]. Важно отметить, что именно mTOR контролирует процессы роста и метаболизма в зависимости от доступности нутриентов (аминокислоты с разветвленной цепью — BCAA), факторов роста (инсулин, инсулиноподобный фактор роста 1 — IGF1) [22]. Главным активатором mTOR являются нутриенты, а факторы роста выполняют вспомогательную функцию. Так, по экспериментальным данным, повышенный уровень лейцина может компенсировать сниженный уровень факторов роста, но не наоборот [23]. Более того, в настоящее время считается, что катаболизм BCAA является одним из регуляторов физиологического старения за счет активации mTOR [24].
Таким образом, рост и старение имеют общие молекулярные механизмы. На первый взгляд может показаться, что рост и процесс старения представляют собой взаимоисключающие процессы. Рост представляет собой процесс синтеза макромолекул из простых нутриентов, построение новых клеток и новых тканей. Старение — нарушение репликации клеток, снижение функции клеток и органов.
Каким образом mTORучаствует в процессах старения и почему ограничение питания на 60—70%увеличивает продолжительность жизни [25]?
Последние данные свидетельствуют, что mTORC1 контролирует процесс старения посредством влияния на целый ряд физиологических процессов, включающих аутофагию, биогенез рибосом, синтез белка, процесс транскрипции и активность митохондрий [26]. Следует помнить, что вышеуказанные процессы составляют нормальную программу клеточного роста, что позволяет считать, что контроль процессов старения является продолжением контроля за процессами роста [27]. Аутофагия — это процесс деградации измененных органелл и белков в лизосомах. Ингибирование процесса аутофагии наблюдается при старении организма и развитии «возрастных» болезней [26]. Показано, что mTOR ингибирует аутофагию, увеличивает количество «старых» клеток с поврежденными ДНК и таким образом сокращает продолжительность жизни [21].
mTOR активирует биогенез в рибосомах и синтез белка. Экспериментальные исследования показали, что ингибирование рибосомального биогенеза и глобального синтеза белка увеличивает продолжительность жизни. mTOR вовлечен в продукцию гипертрофического фенотипа СК. В отсутствии процессов роста стимулирование mTOR увеличивает метаболическую активность, увеличивая размер клетки и синтез макромолекул (белки, РНК, липиды) и органелл. Если клетка продолжает расти без пролиферации, она становится гипертрофичной. Другими словами, если репликция клеток прекращена, то дальнейшая метаболическая активность приводит к гипертрофии. Старение организма — это продолжение клеточного роста в тот период, когда реальный рост организма уже закончен [27], и в этой ситуации mTOR является первопричиной старения клетки, старения организма и развития «возрастных» заболеваний [28]. По мнению M. Blagosklonny и соавт. (2013), mTOR играет роль микрогипоталамуса. Так, глюкоза активирует mTOR, вызывая резистентность к инсулину и IGF1, в то же время активация mTOR увеличивает продукцию инсулина β-клетками поджелудочной железы. Инсулин еще больше стимулирует активность mTOR в адипоцитах, миоцитах, гепатоцитах, увеличивая инсулинорезистентность. Инсулинорезистентность увеличивает уровень глюкозы, которая избыточно стимулирует клетки поджелудочной железы для продукции инсулина. Кульминацией этого процесса является развитие диабета 2-го типа с неблагоприятным исходом. В этой ситуации не задействован гипоталамус, так как каждая клетка содержит молекулярный «гипоталамус» mTOR [28]. Последовательность событий, при которых гиперфункция mTOR приводит к развитию атеросклероза, диабета 2-го типа, широко обсуждается в медицинской прессе.
Для человека взаимосвязь гиперфункции (старение) и нарушения функции можно представить следующим образом:
1) гиперфункция (увеличение функциональной активности клеток), включая гипертрофию, является первичным звеном, которое постепенно нарушает функции и влечет за собой «возрастные» заболевания;
2) снижение функции, нарушение функции и атрофия являются вторичным звеном. Например, гиперстимуляция β-клеток нутриентами может вызывать их апоптоз;
3) повреждение клеток и органов вызывается процессом старения, а не наоборот;
4) повреждение происходит не на молекулярном уровне, а обычно представлено макроповреждением органов и тканей в виде инсульта, инфаркта, метастазов, почечной недостаточности. Повреждение в этом случае имеет форму внезапной «катастрофы», несмотря на то, что гиперфункциональное старение медленно генерировало эти болезни на протяжении десятилетий [29].
Одна из наиболее интересных работ, оценивающих влияние mTOR на продолжительность жизни, проведена в Голландии (Leiden Longevity Study). В этой работе изучалась экспрессия сигнальных молекул mTOR у глубоко пожилых здоровых людей и людей среднего возраста. Анализ эпигенотипа показал, что 7 из 40 генов сигнальных молекул mTOR экспрессируются по-разному у людей двух исследуемых групп. Отличия в экспрессии генов составляли 5% [30]. Поиск путей и нутриентов, влияющих на отличия в экспрессии генов, увеличивающих продолжительность жизни и здоровую старость, может стать одним из важных направлений предупреждения и снижения риска возрастных заболеваний.
Инсулин, IGF1 и продолжительность жизни.
Инсулин/IGF1(IIG) сигнальные пути представляют собой эволюционно сохраняемые пути старения для всех живых организмов от дрожжевых грибков до человека. Первые экспериментальные исследования IIG показали, что снижение сигнальной активности этой оси увеличивает продолжительность жизни. У человека чувствительность к инсулину обычно снижается к пожилому возрасту, и развитие инсулинорезистентности ассоциируется с целым рядом болезней стареющего организма (атеросклероз, ожирение, артериальная гипертензия), что в свою очередь влияет на заболеваемость и смертность пожилых людей [31].
Многочисленные экспериментальные исследования на лабораторных животных с искусственной мутацией в регионах генов IIG выявили влияние нарушения работы этих генов на продолжительность жизни и процессы старения [32]. Появились данные об увеличении продолжительности жизни мышей с удаленным рецептором инсулина (IRS1), снижением активности IRS2, говорящие о том, что эти сигнальные пути (которые также использует IGF1) контролируют процессы старения [33].
Как работают сигнальные пути IIG?
IGF1 связывается со своим рецептором IGF1R, далее начинается процесс фосфорилирования, вследствие чего активируется АКТ (протеин киназа), которая участвует в фосфорилировании вилкообразных факторов транскрипции (FOXO).FOXO выполняет разнообразные биологические функции: участвует в росте органов, реакции тканей на инсулин, регуляции клеточного цикла, ангиогенезе и злокачественном перерождении клеток. Важно то, что IGF1 и инсулин активируют mTOR и соответственно реализуют все действия mTOR, описанные выше [34].
Три аспекта действия гормональной оси являются фундаментальными: 1) влияние инсулина и IGF1 на регуляцию продолжительности жизни сформировалось в период эволюции и жестко сохраняется, указывая, что эти пути активно работают и абсолютно необходимы для выживания; 2) у млекопитающих принципиальным регулятором продолжительности жизни являются гормональные сигнальные пути, которые контролируют жизненно важные физиологические процессы; 3) в регуляции продолжительности жизни участвует вся соматотропная ось, которая регулирует рост и развитие организма [35]. Снижение активности сигнальных путей IIG формирует здоровый фенотип с увеличенной продолжительностью жизни.
Есть ли в организме человека система защиты от процессов старения?
С начала нынешнего столетия внимание ученых стала привлекать группа белков — сиртуинов, участвующих в процессах метаболизма и старения. Сиртуины обнаружены у многих живых организмов, от бактерий до млекопитающих, и вовлечены в регуляцию важных клеточных процессов и метаболических путей.
Сиртуины (англ. sirtuins или Silent Information Regulator 2 proteins, SIR2) — семейство эволюционно консервативных НАД-зависимых белков, обладающих деацетилазной (или АДФрибозилтрансферазной) активностью. Название семейству дано в честь одного из представителей — дрожжевого белка SIR2.
Сиртуины представлены 7 белками, каждый из которых действует отдельно друг от друга и отличается локализацией в клетке. SIR1 в основном располагается в ядре клетки, но также обнаруживается в цитоплазме. SIR2 расположен в цитоплазме, SIR3, 4, 5 располагаются в митохондриях и других органеллах. SIR6 располагается преимущественно в ядре, так же как и SIR7 [36].
Важной функцией сиртуинов является деацетилирование гистонов.
Гистоны принимают непосредственное участие в считывании генетической информации, иначе говоря, ее перезаписи с молекул ДНК на молекулы РНК. При плотной упаковке гистонов такая перезапись не происходит, и гены пребывают в пассивном состоянии. Чтобы тот или иной ген начал работать, связанные с ним гистоны должны несколько разрыхлиться. В этих процессах участвуют различные ферменты, от работы которых зависит плотность гистонной упаковки. К их числу относятся ферменты из группы сиртуинов. Они вынуждают гистоны переходить в состояние с более плотной упаковкой и тем самым затрудняют включение генов.
Около 10 лет назад D. Sinclair и его коллеги из Массачусетского технологического института обнаружили, что гиперэкспрессия сиртуина, который кодируется геном SIR2, замедляет старение дрожжевых клеток. Точнее они обнаружили, что его избыток увеличивает число делений, которые клетки могут претерпевать в течение своей жизни.
Дальнейшие исследования показали, что этот SIR не только меняет плотность гистонной упаковки и тем регулирует активность генов, но и участвует в ремонте повреждений ДНК.Открытие этого эффекта вызвало большой интерес в научной среде и в средствах массовой информации. Однако ученые долгое время не знали, действуют ли сиртуины в таком же качестве и в клетках высших эукариот, прежде всего млекопитающих [37]. Группа исследователей изучила, как зависит здоровье клеток мышей от активности гена SIRT1. Этот ген у млекопитающих отвечает за производство фермента, аналогичного дрожжевому белку, который кодирует ген SIR2.
Оказалось, что функции обоих ферментов очень схожи друг с другом. Это и позволяет утверждать (или, как минимум, предполагать), что сиртуины задействованы в очень древнем механизме клеточного старения, который биологическая эволюция изобрела свыше миллиарда лет назад.
В основе этого механизма лежит постепенное ослабление способности сиртуинов одновременно выполнять обе свои главные функции — деацетилировать гистоны и восстанавливать поврежденную ДНК. Как уже говорилось, эти ферменты уплотняют гистонные каркасы нуклеосом и предотвращают включение тех генов, продукты которых в данный момент клетке не нужны или даже вредны.
Однако сиртуины в то же время помогают устранять поломки ДНК, вызванные ультрафиолетовым излучением или свободными радикалами. При появлении таких дефектов молекулы этих белков мигрируют из мест первоначального расположения в места повреждения. Такая миграция на время ослабляет сиртуиновый контроль за гистонными структурами и потому увеличивает вероятность нештатного включения различных генов. Как показали эксперименты исследователей группы Синклера, степень этой вероятности зависит от возраста. У молодых животных поломки ДНК возникают не так часто, поэтому сиртуины обычно успевают вовремя вернуться к первоначальному месту дислокации. Однако с возрастом клетки начинают производить больше свободных радикалов (в основном, из-за прогрессирующего износа органов внутриклеточного дыхания, митохондрий). Из-за этого сиртуины покидают места постоянной дислокации чаще и на более длительное время, а потому хуже контролируют плотность гистонов.
По данным L. Guarente, SIR1 является одним из самых сильных регуляторов метаболизма. В клетках млекопитающих SIR1 влияет на липидный обмен, снижая активность PPARγ, регулирует липидный гомеостаз. В клетках поджелудочной железы SIR1 регулирует секрецию инсулина, гомеостаз глюкозы [38].
Известно, что единственно доказанным способом замедления старения человека является ограничение калорийности рациона. Медиатором действия этого способа является повышение уровня и активности SIR1.
Ученые показали, что SIR3 деацетилирует и тем самым активирует центральный регулятор метаболизма в митохондриальном матриксе — глутаматдегидрогеназу. Кроме того, SIR3 деацетилирует и активирует изоцитратдегидрогеназу 2, фермент, который обеспечивает регенерацию антиоксидантов и катализирует ключевые реакции цитратного цикла [39].
Младенческие истоки раннего старения.
Постнатальная пластичность нейроэнодокринной среды влияет на развитие соматотропной оси. Триггером развития и тех или иных изменений этой оси является характер питания в первые недели постнатальной жизни. В экспериментальных исследованиях на новорожденных мышах использовали 3 варианта рациона: ограниченное питание материнским молоком, нормальное питание и избыточное питание. Этот рацион сохранялся до введения прикорма и ограничения лактации. После введения прикорма все экспериментальные животные получали одинаковый рацион. Недостаточное питание в первые 2 недели жизни приводило к нарушению роста, причем при переходе к нормальному рациону рост не восстанавливался. После 2 недель недостаточного или избыточного питания происходили нарушения секреции гормона роста (ГР) и экспрессии его рецептора (ГРР). Уже в первую неделю жизни отмечены снижение уровня IGF1 у животных с ограниченным рационом и повышение уровня IGF1 у животных с избыточным питанием. Важно отметить, что эти нарушения сохранялись и были более выражены во взрослой жизни животных. Выявлены значимое снижение уровня IGF1 и ГР у животных
Метаболический/эндокринный ответ на разный уровень потребления белка в младенчестве [44]

с ограниченным питанием в раннем постнатальном периоде и значимое повышение уровня IGF1 и ГР у животных с избыточным питанием (рис. 2) [40]. Ограничение питания в постнатальном возрасте снижает соматотропную активность во взрослом организме. Таким образом, происходит процесс программирования нейроэндокринных функций, состояния здоровья и продолжительности жизни в зависимости от характера питания в постнатальном периоде.
Близкие примеры можно найти при исследовании детей. Так, в работе Gunter (2013) обнаружено снижение индекса инсулинорезистентности (HOMA-IR) у женщин, длительно получавших грудное вскармливани [41]. В клинических исследованиях грудных детей, получающих смеси с разным содержанием белка, было показано, что увеличение уровня белка в продукте увеличивает уровень IGF1 в крови детей в 4-месячном возрасте [42]. Снижение уровня белка в продукте до 12 г/л позволяет значимо снизить уровень IGF1 (см. таблицу) [43, 44]. В работе Ong и соавт. было выявлено, что высокая скорость роста детей на первом году жизни приводит к повышению уровня IGF1 в возрасте 5 лет, а вскармливание искусственной смесью с повышенным содержанием белка (14 г/л) увеличивает уровень IGF1 и инсулина (рис. 3) [45]. Эти данные говорят о важности постнатального питания для роста, развития, здоровья и продолжительности жизни.
По мнению ученых, «широкая метаболическая траектория устанавливается и фиксируется в младенчестве и может повлечь за собой нарушение метаболической адаптации во взрослой жизни».
Многочисленные программы, направленные на улучшение показателей здоровья населения и увеличения продолжительности жизни разрабатываются во всех крупных развитых странах. Большинство программ направлено на улучшение рационов питания, повышение двигательной активности, создание образовательных программ. Однако современные данные о ранних истоках тяжелых заболеваний и процессах старения свидетельствуют о том, что профилактические мероприятия должны начинаться на самых ранних этапах развития.
Конфликт интересов: автор является руководителем Института питания Нестле. В статье нет ссылок или упоминания продуктов компании Нестле.


1. Boccardi V, Paolisso G, Mecocci P. Nutrition and life style in healthy aging: the telomerase challenge. Aging. 2016; 8 (1): 12–15.
2. Sohal RS, Orr WC. The redox stress hypothesis of aging. Free Radic. Biol. Med. 2012; 52 (3): 951–957.
3. Soares J, Cortinhas A, Bento T, Leitao J, Collons A, et al. Aging and DNA damage in humans: a meta-analysis study. Aging. 2014; 6 (6): 432–439.
4. Lawler D. The changing understanding of ageing. Part1. Evaluating ageing theories and studies. Veter. Italiana. 2011; 47: 229–240.
5. Tarry-Adkins J, Marti-Gronert M, Fernandez-Twinn D, et al. Poor maternal nutrition followed be accelerated postnatal growth leads to alterations in DNA damage and repair. Oxidative abdnitrosativestress, and oxidative defense capacity in ray heart. The FASEB J. 2013; 27: 379–390.
6. Bernadotte A, Mikhelson V, Spivak I. Markers of cellular senescence. Telomer shortening as a marker of cellular senescence. Aging. 2016; 8 (1): 3–11.
7. Hayflick L, Moorhead PS. The serial cultivation of human diploid cell strains. Exp. Cell Res. 1961; 25: 585–621.
8. Ishikawa N, Nakamura K, Izumiyama N, et al. Changes of telomere status with aging: An update. Geriartics Gerontology Int. 2016; 16 (Suppl. 1): 30–42.
9. Armanios M. Telomeres and age-related disease: how telomere biology informs clinical paradigm. The J. of Clin. Invest. 2013; 123 (3): 996–1002.
10. Smeets C, Codd V, Samani N, et al. Leukocyte telomet length in young adults bone preterm: support for accelerated biological aging. PLOSONE. 2015; 30: 1–11.
11. Raqib R, Alam D, Sarker P, et al. Low birth weight associated with altered immune function in rural Bangladeshi children: a birth cohort study. AJCN. 2007; 85: 845–852.
12. Turner K, Vasu V, Greenall J. Telomere length analysis and preterm infant health: the importance of assay design in the search for novel biomarker. Biomarkers Med. 2014; 8 (4): 486–498.
13. Guzzardi M, Lozzo P, Salonen M, et al. Maternal adiposity and infancy growth predict later telomere length: a longitudinal cohort study. Int. J. of Obesity. 2016; 40: 1063–1069.
14. Passos J, Saretzki G, Zglinicki T. DNA damage in telomere and mitochondria during cellular senescence: is there a connection &Nucleic Acid Res. 2007; 35 (22): 7505–7513.
15. Gabuzda D, Yankner B. Inflammation links ageing to the brain. Nature. 2013; 9: 497–451.
16. Prattichizzo F, De Nigris V, La Sala L, et al. Inflammaging as a druggable target: a senescence-associated secretory phenotype — centered view of type 2 diabetes. Oxidative Medicine and Cellular Longevity. 2016; article ID 1810327 10 р.
17. Tang Y, Purkayastha S, Cai D. Hypothalamic microinflammation: a common basis for metabolic syndrome and aging. Trends Neurоsc. 2015; 38 (1): 36–44.
18. Sadagurski M, Landeryou T, Cady G, et al. Transient early food restriction leads to gypothalamic changes in the longlived crowded litter female mice. Physisol. Reports. 2015; 3 (4): e12379—e13390.
19. Meydani S, Das S, Pieper C, et al. Long-term moderate calorie restriction without impairing cell-mediated immunity: a randomized controlled trial in non-obese humans. Aging. 2016; 8 (7): 1416–1425.
20. Kennedy B,Lamming D. The mechanistic target of rapamycin: the grand ConducTOR of metabolism and aging. Cell Metabolism. 2016; 23: 990–997.
21. Blagosklonny M, Hall M. Growth and aging: a common molecular mechanism. Aging. 2009; 1 (4): 357–362.
22. Wullschleger S, Loewith R, Hall M. TOR signaling in growth and metabolism. Cell. 2006; 124: 471–484.
23. Avruch J, Hara K, Lin Y, et al. Insulin and amino acid regulation of mTOR signaling and kinase activity through the RhebGTPase. Oncogene. 2006; 25: 6361–6372.
24. Mansfeld J, Urban N, Priebe S, et al. Branched-chain amino acids catabolism is a conserved regulator of physiological ageing. Nature Communication. 2015; 6: 10034–10046.
25. Guarenter L, Picard F. Calorie restriction — the SIRT2 connection. Cell. 2005; 120: 473–482.
26. Klionsky D. Autophagy: from phenomenology to molecular understanding in less than a decade. Nat. Rev. Mol. Cell Biology. 2006; 8 (11): 931–937.
27. Demidenko Z, Blagosklonny M. Groth stimulation leads to cellular senescence when the cell cycle is blocked. Cell Cycle. 2008; 7: 3355–3361.
28. Blagosklonny M. M(o)TOR of aging: mTOR as a universal molecular hypothalamus. Aging. 2013; 6 (7): 490–494.
29. Blagosklonny MV. Answering the ultimate question «What is the proximal cause if aging?» Aging. 2012; 4 (12): 861–871.
30. Passtoors W, Beekman M, Deelen J, et al. Gene expression analysis of mTOR pathway: association with human longevity. Aging. Cell. 2012; 12: 24–31.
31. Barbieri M, Bonafe M, Franceschi C, et al. Insulin/IGF1-signaling pathway: an evolutionarily conserved mechanism of longevity from yeast to humans. Am. J. Physio. Endocrinol. Metab. 2003; 285: E1064—E1071.
32. Sell C. Minoreview: The complexities of IGF/Insulin signaling in aging: Why flies and worms are not humans. Mol. Endocrinol. 2015; 29 (8): 1107–1113.
33. Bartke A. Impact of reduced insulin-like growth factor/insulin signaling on aging in mammals: novel findings. Aging. Cell. 2008; 7: 285–290.
34. El Ami T, Moll L, Marques F, et al. A novel ingibitor of the insulin/IGF signaling pathway protects from age-onset, neurodegeneration-linked proteotoxicity. Aging. Cell. 2014; 13: 165–174.
35. Holzenberger M. IGF1 signaling and effects on longevity. Nestle Nutr. Inst. Ser. Pediatr. Program. 2011; 68: 237–249.
36. Giblin W, Skinner M, Lombard D. Sirtuins: Gardians of mammalian healthspan, Trend Genet. 2014; 30 (7): 271–286.
37. Sinclair DA1, Oberdoerffer P. The ageing epigenome: damaged beyond repair?Ageing Res. Rev. 2009; 8 (3): 189–198.
38. Guarenter L. Sirtuins in aging and disease. Cod Spring Harb. Symp. Quant Biol. 2007; 72: 483–488.
39. Schlicker C1, Gertz M, Papatheodorou P, et al. Substrates and regulation mechanisms for the human mitochondrial sirtuins Sirt3 and Sirt5. J. Mol. Biol. 2008; 382 (3): 790–801.
40. Kappeler L, De MagalharsFilho C, L, Lenruve P, et al. Early postnatal nutrition determines somatotropic function in mice. Endocrinology. 2009; 150 (1): 314–323.
41. Gunther A, Walz H, Kroke A, et al. Breastfeeding and its prospective association with componenets of the GH-OGFAxis, insulin resistance and body adiposity measures in youn adulthood — insights from linear and quantile regression analysis. PLOSONE. 2013; 8 (11): e79436.
42. Ziegler E. Growth of breast-fed and formula-fed infants. In: Protein and energy requirements in infancy and childhood. Nestle Nutrition Workshop Series. Karger AG, Basel. 2006; 58: 51–63.
43. Weber M, Grote V, Closa-Monasterolo R. Koletzko B, von Kries R, Closa R Grusfeld D, Socha P, Dain E. Lower protein content in infant formula reduces BMI and obesity risk at school age: follow-on of randomized trial. AJCN. 2014; 99: 1041–1051.
44. Socha P, Hellmuth C, Griszfeld D, et al. Endocrine and metabolic biomarkers predicting early childhood obesity risk. NetsleNutr. Institute series. Preventive aspects of early nutrition. 2016; 85: 81–88.
45. Ong K, Ahmed M, Emmett P, et al. Association between postnatal catch-up growth and obesity in childhood: prospective cohort studies. BMJ. 2000; 320: 967–971.
Наш сайт в формате приложения всегда под рукой!
Нажмите на кнопку ниже и запустите установку приложения на следующей странице. При первом входе приложение запросит у вас разрешение на уведомления. Пожалуйста, нажмите «Да», если разрешаете приложению Nestle Baby&me Medical отправлять рекламные и информационные уведомления.
НачатьПриложение запросит у вас разрешение на уведомления. Пожалуйста, нажмите «Да», если разрешаете приложению Nestle Baby&me Medical отправлять рекламные и информационные уведомления.
Хорошо- 1. Нажмите на значок «Поделиться», он находится рядом с адресной строкой.
- 2. Выберите «Добавить на главный экран» и нажмите «Добавить».
ЭКСКЛЮЗИВ!
Новика Г.А. и Макаровой С.Г.