Полный доступ для зарегистрированных пользователей
Полный доступ для зарегистрированных пользователей
О.К. Нетребенко, С.Е. Украинцев, М.И. Дубровская
ГБОУ ВПО РНИМУ им. Н.И. Пирогова МЗ РФ; ООО «Нестле» Россия, Москва, РФ
Профилактическая медицина:
питание младенца и программирование здоровья
Контактная информация:
Нетребенко Ольга Константиновна – д.м.н., проф. каф. госпитальной педиатрии № 1 ГБОУ ВПО РНИМУ им. Н.И. Пирогова МЗ РФ
Адрес: Россия, 117997, г. Москва, ул. Островитянова, 1
Тел.: (499) 725-70-00,
E-mail: olga.netrebenko@ru.nestle.com
Статья поступила 17.12.15, принята к печати 11.01.16.
Рассматриваются альтернативные вопросы профилактической педиатрии, связанные с современной концепцией программирования питанием. Основы целого ряда заболеваний детей и взрослых – ожирения, аллергических заболеваний, а также других хронических неинфекционных заболеваний (сердечно-сосудистые заболевания, бронхиальная астма и др.), которые снижают качество жизни, приводя к ранней инвалидизации и смерти, закладываются (программируются) еще в период внутриутробного развития и на первом году жизни. Основные факторы, влияющие на процессы пищевого программирования на первом году жизни, связаны с характером вскармливания, состоянием кишечной микробиоты и наличием ингредиентов, обладающих противовоспалительной активностью. Приводятся данные по наличию эпигенетических маркеров в грудном молоке. Рассматриваются неблагоприятные элементы программирования, связанные с избыточным потреблением белка, нарушением состояния кишечной микробиоты.
Когда мы говорим о профилактической медицине, на первый план выходят диспансеризация больных детей и взрослых и профилактические осмотры здоровых с целью выявления тех или иных отклонений здоровья. В свете современных представлений о процессах пищевого программирования на ранних этапах развития эти мероприятия представляются нужными, но недостаточными, поскольку время их проведения часто совпадает с выявлением уже имеющихся отклонений в состоянии здоровья. Действительно, основы целого ряда заболеваний детей и взрослых – ожирения, аллергических заболеваний, а также других хронических неинфекционных заболеваний (сердечно-сосудистые заболевания, бронхиальная астма и др.), которые снижают качество жизни, приводя к ранней инвалидизации и смерти, закладываются (программируются) еще в период внутриутробного развития и на первом году жизни и тесно связаны с питанием младенца.
Что и как программируется?
Программирование – это процесс, в котором под влиянием факторов внешней среды и питания изменяется активность и соответственно функция отдельных генов, которая влечет за собой изменения метаболизма. Например, при нарушении внутриутробного развития, связанного с дефицитом нутриентов, гипоксией, фетоплацентарной недостаточностью, адипоциты плода проходят процесс внутриутробного программирования в виде усиления адипогенеза путем более высокой экспрессии PPAR-γ и повышения синтеза жирных кислот [1]. Внутриутробное программирование адипоцитов увеличивает пролиферацию и дифференциацию преадипоцитов, а также аккумулирование липидов, что удалось обнаружить сразу после рождения детей с задержкой внутриутробного развития (ЗВУР) [2]. Считается, что повышение адипогенеза потомства при недостаточном питании во время беременности носит адаптационный характер и укладывается в понятие «экономный» фенотип, предложенный Нales (2001). Согласно этой гипотезе, недостаточное питание во внутриутробной жизни направляет метаболизм плода в сторону накопления и сохранения энергии с усиленным липидным обменом [3]. Избыточное питание беременной, ожирение, диабет программируют увеличение массы плода и увеличивают риск ожирения у потомства.
Наиболее хорошо изучены 3 основных эпигенетических механизма программирования: метилирование ДНК, модификация гистона и действие микро-РНК. Благодаря действию этих механизмов эпигенетики и происходит изменение функции генов. Питание детей является источником нутриентов, способных изменить направленность метаболизма и состояние здоровья.
Программирование питания в постнатальном периоде определяется характером вскармливания младенца. Хорошо известно, что грудное молоко (ГМ) обладает защитным эффектом и снижает риск развития некротизирующего энтероколита, инфекционных заболеваний, а также хронических неинфекционных заболеваний, таких как ожирение и аллергические состояния. Есть убедительные доказательства влияния отдельных компонентов ГМ на экспрессию генов (см. таблицу). В последние годы большое внимание ученых привлекают данные о наличии в ГМ и детских молочных смесях (ДМС) еще одного важного фактора программирования – микроРНК (МР), представляющих собой малые некодирующие молекулы РНК длиной 18–25 нуклеотидов (в среднем 22); МР участвуют в подавлении активности генов: они комплементарно спариваются с участками мРНК и ингибируют их трансляцию. Это означает, что МР связываются мРНК и ингибируют экспрессию гена, ответственного за синтез конкретного белка. По некоторым данным, МР регулируют экспрессию до 50% всех генов человека МР, работу многих физиологических процессов в организме: репрограммирование соматических клеток в стволовые клетки, состояние и работу иммунной системы, включая развитие Т- и В-лимфоцитов, пролиферацию нейтрофилов, высвобождение медиаторов воспаления, дифференциацию дендритных клеток и много другое [4].
ГМ, содержащее до 1400 разнообразных МР, является их самым важным источником для адекватного развития младенца. Содержание МР в ДМС намного ниже по сравнению с ГМ, они обладают сниженной активностью [5].
ГМ содержит целый ряд макро- и микронутриентов, способных влиять на процессы программирования питания. К ним относятся такие микронутриенты, как фолиевая кислота, цинк, холин, витамины В6 и В12. Эти нутриенты прямо связаны с процессами метилирования ДНК и изменением функции гена. Поэтому практически все ДМС включают эти микронутриенты в свой состав.
Более сложно оценить действие макронутриентов, прежде всего белков. Известно, что количество и состав белков ГМ существенно отличаются от количества и состава белков ДМС.
Повышенный уровень белка в ДМС увеличивает уровень аминокислот (АК) в плазме крови у детей, особенно АК с разветвленной цепью (АРЦ) – лейцин, валин, изолейцин [6]. Теоретически избыток АК может легко деградироваться под действием ферментных систем, однако, согласно современным данным, уровень фермента, метаболизирующего АРЦ (кетоацид дегидрогеназа), относительно снижен в печени и при высоком поступлении АРЦ наступает насыщение метаболических систем печени, и уровень АРЦ остается высоким в плазме крови. Экспериментальные исследования доказывают, что более высокое потребление белка в питании животных сопровождается большей скоростью роста, более высокой ретенцией азота, задержкой большего количества воды и минералов [7].
По данным N. Butte, скорость прибавки массы тела у детей в возрасте 3–6 и 6–9 месяцев достоверно выше на искусственном вскармливании по сравнению с естественным с наиболее выраженными отличиями в возрасте 6 месяцев [8].
В литературе имеется немало клинических исследований, связывающих избыточную прибавку массы тела в младенчестве с риском развития ожирения и метаболического синдрома в дальнейшем. Долговременные независимые исследования детей от рождения до 17 лет, проведенные в Швеции, показали, что у детей с высокой скоростью роста в первые 6 мес жизни в возрасте 17 лет достоверно более часто наблюдались увеличение окружности живота за счет накопления абдоминального жира, более высокий уровень артериального давления (АД), признаки резистентности к инсулину и нарушение липидного обмена [9]. Анализ характера роста детей во Франции показал, что прибавка веса в возрасте от 3 до 6 месяцев жизни являлась прогностическим фактором увеличения жировой массы тела в подростковом возрасте [10]. Высокая скорость роста в младенчестве увеличивает общее количество жира в организме, включая висцеральный и подкожный жир в возрасте 45 лет [11]. Следует отметить, что в случаях избыточного питания и высокой скорости роста в младенчестве наблюдаются и изменения со стороны сосудов и сердца. В частности, высокая скорость роста в первые 18 месяцев, помимо повышения индекса массы тела (ИМТ), вызывает нарушения состояния эндотелия сосудов и повышение уровня систолического АД у детей в 8-летнем возрасте [12]. В последних экспериментальных исследованиях показано, что избыточное питание в раннем младенчестве вызывает ранние и отсроченные изменения сердечной деятельности. Ранние изменения включают нарушения экспрессии генов, ответственных за продукцию сигнальных молекул и развитие гипертрофии миокарда. Отдаленные последствия перекорма в младенчестве связаны с окислительным стрессом, снижением активности сердечных сокращений, фиброзом, повышением чувствительности к ишемии, артериальной гипертензией [13].
Таблица
Эпигенетическое действие грудного молока*
*По данным E. Verduci, 2014 [4].
Действие АК при вскармливании ДМС
В большинстве ДМС уровень белка составляет 13–15 г/л, что на 30–50% выше по сравнению с белком ГМ, поэтому уровень АК у детей, получающих такие смеси, достоверно выше по сравнению с детьми, получающими ГМ [14]. Известно, что АК (АРЦ) являются мощным стимулятором выброса инсулина, а также увеличивают продукцию инсулиноподобного фактора роста (ИФР-1) [15, 16]. Оба гормона обладают свойствами усиливать адипогенез; кроме того, повышение уровня инсулина снижает экспрессию рецепторов инсулина в адипоцитах [17]. В условиях гиперинсулинемии снижается концентрация белков, связывающих ИФР, и повышается уровень свободного ИФР-1 в плазме крови [18], что является пусковым механизмом ускорения темпов роста. По принципу «отрицательной обратной связи» уменьшается секреция гормона роста и снижается уровень липолиза. Исследователи предполагают, что более высокое потребление белка в младенчестве долговременно программирует ось гормон роста/ИФР, особенно у мальчиков [19].
mTOR – метаболизм и иммунитет
В последние годы появились данные о новом действии АК и их особом влиянии на метаболизм и иммунитет, что осуществляется посредством активации комплекса mTOR. Комплекс mTOR – это группа серин/треонин киназ (сигнальные молекулы), который возник эволюционно в процессе развития организма человека. Задача комплекса – обеспечение роста и развития в зависимости от доступности нутриентов. Изучение действия комплекса mTOR показало, что его активация в младенчестве закладывает основы будущего здоровья, так как именно АК, в частности лейцин, в питании младенца активируют работу комплекса mTOR. В нормальных условиях комплекс mTOR находится в цитоплазме клеток в неактивном состоянии. Повышение уровня АК в плазме крови изменяет структурный состав лизосомной протонной помпы, которая служит медиатором захвата mTOR в лизосомы для обеспечения контакта mTOR и его активатором Rheb [20]. Повышение уровня лейцина релокализует и активирует комплекс mTOR. Далее под воздействием инсулина и ИФР-1 mTOR активирует процессы быстрой пролиферации клеток, изменяет морфогенез жировой ткани, способствует процессам адипогенеза, развитию инсулинорезистентности [21]. Таким образом, под воздействием высокого уровня белка в ДМС запускается процесс высокой активации комплекса mTOR, приводящий к долговременным последствиям, связанным прежде
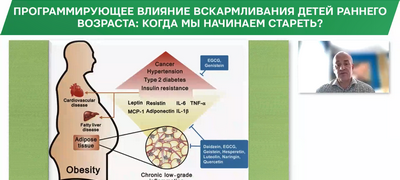
всего с увеличением скорости роста и количества адипоцитов с увеличением риска развития ожирения [22]. Другим последствием является изменение иммунного статуса ребенка (рис. 1). Комплекс mTOR регулирует функциональное состояние и метаболизм почти всех клеток иммунной системы, и активность mTOR влияет на характер иммунного ответа. Появляются доказательства того, что Т-лимфоциты обладают активными метаболическими свойствами; направление метаболизма Т-клеток определяет их дифференциацию. Высокий уровень АРЦ и некоторых других эссенциальных АК снижает продукцию Т-регуляторных клеток и больше связан с процессами воспаления. Ингибирование активности mTOR связано с индукцией популяции Т-регуляторных клеток и формированием толерантности (рис. 2). Ученые предполагают, что активация комплекса mTOR – это связующее звено между метаболизмом и иммунитетом и что уровень эссенциальных АК в младенчестве формирует иммунологический баланс в организме человека [23, 24]. Учитывая важную роль характера питания и скорости роста в развитии метаболизма и иммунных функций, в нескольких исследованиях сделана попытка сопоставить скорость роста в младенчестве с развитием впоследствии бронхиальной астмы. Действительно, высокая скорость роста на первом году жизни увеличивала риск развития астмы к 8-летнему возрасту [25]. Мета-анализ исследований подтвердил это предположение [26]. Здесь можно говорить о важном клиническом заключении: скорость роста ребенка на первом году жизни влияет на функциональное состояние легких и вносит вклад в развитие обструктивных болезней в последующей жизни. Таким образом, профилактическое направление современной педиатрии должно начинаться с поддержки и продвижения грудного вскармливания, а при его отсутствии – использование ДМС с наименьшим уровнем белка (12 г/л).
Второе направление профилактики связано с обеспечением адекватной колонизации кишечника младенца.
Концепция программирования питанием касается не только метаболических и иммунных нарушения, но также включает развитие микробиома и установление симбиоза в первые 1000 дней жизни [27]. Первичная колонизация кишечника новорожденного закладывает основы долговременного стабильного микробиома ребенка и взрослого человека [28]. Однако это привычное представление в последнее время претерпевает изменения. В настоящее время появились убедительные доказательства наличия микробов в плаценте, и появилось понятие микробиом плаценты. Показано, что комменсальная микробиота обнаруживается в плаценте и амниотической жидкости, включая бифидобактерии (ББ) и лактобациллы (ЛБ); при физиологических состояниях организма эти микробы примируют и инициируют иммунный ответ. Исследование Satokari (2008) показало наличие ББ и ЛБ во всех исследуемых образцах плаценты, полученной после нормальных срочных родов [29]. Бактерии в плаценте так же, как и в ГМ предположительно проходят транслокацию из кишечника матери [30]. Интересно отметить, что микробиом плаценты больше похож на микробиом полости рта матери, чем на вагинальный микробиом.
Известно, что кишечная микробиота (КМ) взрослого человека определяется в основном характером питания. Что еще может влиять на КМ женщины в период беременности?
Беременность и состав КМ
В исследовании M.C. Collado и соавт. показано влияние ИМТ матери перед беременностью и ее весовых прибавок во время беременности на становление микробиоты ребенка в течение первых 6 мес жизни. Была выявлена прямая корреляция между ИМТ матери и количеством бактероидов, клостридий и стафилококков у ребенка. Ожирение матери и избыточные весовые прибавки во время беременности сочетались с низким уровнем ББ у ребенка [31]. С учетом того, что материнская микробиота при родах передается младенцу, можно предполагать, что снижение уровня ББ может наблюдаться и у младенца, что впоследствии может привести к развитию избыточной массы тела. Исследования A. Santacruz (2010) также показали, что избыточный вес и ожирение в период беременности изменяют состав КМ. В этой работе наблюдались 2 группы беременных женщин с ИМТ > 25 и ИМТ < 25 кг/м2 [32]. В биохимических показателях женщин с избыточным весом выявлены повышение уровня триглицеридов и общего холестерина и снижение уровня фолиевой кислоты и железа. По некоторым данным, ожирение у женщины считается фактором риска развития дефекта нервной трубки. Возможно, это связано со снижением содержания ББ в микробиоте женщин с ожирением, так как есть данные, что именно ББ синтезируют и секретируют фолиевую кислоту. Повышение уровня ББ коррелировало с повышением уровня фолиевой кислоты.
Таким образом, у женщин с избыточным весом и ожирением ребенок, проходя по родовым путям матери, не получает адекватного количества ББ, а колонизируется менее благоприятной микрофлорой. Важно отметить, что у детей в возрасте 6 месяцев, родившихся у матерей с повышенным ИМТ, наблюдалось снижение уровня ББ в стуле по сравнению с детьми, родившимися у здоровых матерей [33]. Кроме того, что у матерей с избыточным весом и ожирением также наблюдаются достоверные изменения в составе микробиома ГМ [34].
Действительно, в работе Kalliomaki и соавт. (2007) было показано, что у детей со сниженным уровнем ББ на первом году жизни более высок риск развития ожирения к 7-летнему возрасту. Кроме того, у этих детей в младенчестве наблюдался более высокий уровень стафилококков, что соответствует его повышенному уровню у беременных женщин с избыточной массой тела и также женщин с высокой прибавкой массы тела во время беременности [33].
Нарушения нормальной колонизации кишечника младенца связаны с оперативным родоразрешением, при котором отсутствует контакт родовых путей матери и ребенка, использованием антибиотиков у матери и/или ребенка, отсутствием грудного вскармливания. Последствия нарушения КМ связаны с нарушением адекватного функционирования иммунной системы, увеличенным риском аллергических заболеваний, метаболических нарушений. Согласно данным последних исследований, кесарево сечение (КС) достоверно увеличивает риск развития астмы и других респираторных нарушений (р < 0,003), ожирения и других метаболических расстройств (р < 0,001) [35]. Здоровая КМ обеспечивает резистентность к патогенам, поддерживает гомеостаз иммунной системы, стимулирует развитие пейеровых бляшек, контролирует иммунный ответ и способствует развитию толерантности.
Последствия нарушения КМ у ребенка затрагивают многие органы и системы организма. Известно, что здоровая КМ обладает способностью повышать целостность кишечной стенки за счет повышения экспрессии генов, продуцирующих белки плотных сочленений; снижает активность продукции провоспалительных цитокинов и повышает продукцию Т-регуляторных клеток; стимулирует выработку IgА [36].
Грудное вскармливание новорожденного ребенка во многом является определяющим фактором развития микробной колонизации кишечника. У здоровых детей, получающих грудное вскармливание, доминирующей флорой кишечника являются ББ, и создается впечатление, что рост других бактерий подавляется [36]. У детей, получающих ДМС, во многих случаях также преобладают ББ, однако их количество у детей на грудном вскармливании практически в 10 раз выше по сравнению с детьми, получающими ДМС [37]. ББ составляют 80–95% микрофлоры ребенка, получающего материнское молоко, до введения прикорма и 20–25% микрофлоры взрослого человека. У детей в возрасте 1 месяца выявлена прямая связь уровня ББ с продукцией секреторного IgА, кроме того, отмечено снижение уровня провоспалительного цитокина IL6 [38].
В настоящее время хорошо известно, что ГМ, как и плацента, не является стерильным, а содержит те бактерии, которые присутствуют в кишечнике матери. В последних работах, посвященных этому вопросу, отмечено, что в ГМ женщины содержится приблизительно 700 разных видов бактерий и даже появилось понятие «микробиом грудного молока» [34]. Учитывая данные о микробиоме ГМ и неблагоприятных последствиях нарушения состава и качества КМ, встает вопрос о целесообразности использования пробиотиков для нормализации состава КМ.
Пробиотики в питании грудных детей
Изучение пробиотиков и их действия на организм человека началось сравнительно недавно, хотя первые научные данные о пользе ферментированного молока были представлены в работе И.И. Мечникова в начале прошлого века. В наше время интерес к пробиотикам вызван необходимостью поиска мер борьбы с иммуноопосредованными заболеваниями (аллергия, аутоиммунные заболевания, хронические воспалительные заболевания), а также полученными научными данными о влиянии КМ на развитие иммунитета. Нарушение иммунного ответа, связанное с нарушенной колонизацией кишечника в младенчестве, по-видимому, можно предотвратить использованием пробиотиков.
Современные исследования доказали, что изменения КМ у младенцев предшествуют развитию атопического дерматита [39]. На протяжении последних 20 лет проведено 25 рандомизированных двойных слепых плацебоконтролируемых исследований профилактических и лечебных свойств пробиотиков. В большинстве исследований в качестве пробиотика использовалась L. rhamnosus. Выявлено, что использование L. rhamnosus в последнем триместре беременности и после рождения ребенка достоверно снижало частоту случаев атопии у детей [40, 41].
В аналогичном по дизайну исследовании L. reuteri также получен благоприятный результат снижения риска развития атопии у детей [42]. Исследование Rautava (2012), в котором в период беременности использовалось сочетание L. rhamnosus+B. longum, показало высокодостоверное снижение числа случаев атопии у детей [43]. Следует отметить, что, по данным Kalliomaki (2010), превентивный эффект пробиотиков сохранялся на протяжении 7 лет, однако достоверно выражен он был у детей, родившихся КС [44]. По-видимому, профилактическое действие пробиотиков связано с характером КМ. Данные других авторов также подтверждают это положение [40].
Нарушения характера КМ на первом году жизни является прогностическим фактором развития ожирения в возрасте 4 лет [33].
Представляют большой интерес экспериментальные исследования механизма действия пробиотиков. На культуре клеток кишечника было показано, что пробиотики (L. rhamnosus) предотвращают индуцированный провоспалительными цитокинами апоптоз энтероцитов кишечника. Более того, белки, продуцируемые этим пробиотиком (p40 и p75), увеличивают пролиферацию и рост клеток кишечника и обладают выраженным заживляющим действием на кишечную стенку [45].
Обобщая экспериментальные данные, можно отметить значимое влияние пробиотиков на функциональное состояние эпителиальных клеток, ответ Т-клеток, действие дендритных клеток:
- повышение целостности эпителиального барьера;
- модуляция сигнальных путей взаимодействия КМ и клеток кишечника в сторону снижения процессов воспаления;
- индукция толерогенных дендритных клеток, снижающих уровень продукции IFNγ и повышающих продукцию регуляторного цитокина IL10;
- индукция активности T-регуляторных клеток с повышением продукции регуляторных цитокинов лимфоцитами;
- стимуляция продукции IgА [46].
Механизмы действия пробиотиков связаны с их влиянием на экспрессию генов и процессы программирования. Одним из доказанных медиаторов действия пробиотиков являются короткоцепочечные жирные кислоты (КЦЖК), появляющиеся в результате ферментации компонентов рациона в толстой кишке. КЦЖК обладают действенным противовоспалительным эффектом, и их снижение наблюдается при воспалительных заболеваниях. Известно, что бутират повышает целостность эпителиального барьера кишечника за счет модуляции экспрессии белков, формирующих плотные сочленения. Кроме того, бутират известен как «эпигенетическое» лекарство, обладающее противоопухолевым действием, и предполагается, что противовоспалительное действие пробиотиков связано с продукцией КЦЖК [47].
В последние годы появился ряд экспериментальных и клинических исследований, демонстрирующих важную роль длинноцепочечных полиненасыщенных жирных кислот (ДПНЖК) в регуляции экспрессии генов, связанных с процессами воспаления и метаболизма липидов.
ДПНЖК в питании младенца и процессы программирования
Процессы экспрессии генов связаны с рядом факторов транскрипции, в частности, ядерными пероксисомально-пролиферативными рецепторами (PPARα, PPARγ, PPARδ). PPAR рецепторы относятся к особому виду ядерных рецепторов, которые регулируют экспрессию генов в клетке в ответ на связывание со специфическим для данного рецептора лигандом. PPAR расшифровывается как «рецептор, активирующий пролиферацию пероксисом» (анг. Peroxisome Proliferator-Activated Receptor). Эти рецепторы являются физиологическими сенсорами (транскрипторами) липидного и углеводного обмена. Экспериментальные исследования доказали, что докозогексаеновая кислота (DHA) и эйкозапентаеновая кислота (EPA) являются лигандами (агонистами) этих рецепторов, приводящими к активации PPAR [48]. К настоящему времени выявлены и основательно изучены подклассы PPAR – PPAR-α, PPAR-γ, PPAR-β/δ. Все эти рецепторы играют важную роль в энергетическом метаболизме, однако имеют различный спектр активности. PPAR-γ регулирует запасы энергии и экспрессируется практически во всех тканях; PPAR-α экспрессируется преимущественно в гепатоцитах, энтероцитах, иммунокомпетентных клетках (макрофагах, моноцитах), эндотелиальных клетках.
PPAR-α играет ключевую роль в окислении жирных кислот для обеспечения энергией периферических тканей; в клинических исследованиях снижает липидемию у больных с метаболическим синдромом, активируется эндогенными жирными кислотами [49]. PPAR-γ контролирует экспрессию множества генов, связанных с обменом липидов, регулирует дифференциацию адипоцитов, депонирование жирных кислот и метаболизм глюкозы. Недостаточная экспрессия этих рецепторов, так же как и избыточная, приводит к нарушениям обмена липидов.
По данным M. Bowens и соавт. (2009), повышенное потребление EPA/DHA на протяжении 26 недель снижает экспрессию 1040 генов, вовлеченных в развитие процесса воспаления, атерогенеза, адипогенеза. Механизм такого действия омега-3 ДПНЖК связан со снижением активности PPAR-α с последующим снижением уровня жирных кислот и триглицеридов в плазме крови. Важно отметить, что использование EPA и DHA в питании регулирует экспрессию генов, связанных и с процессами воспаления, и с метаболизмом липидов, т.е. влияет на механизмы развития заболеваний, в основе которых лежит процесс хронического воспаления (ожирение, атеросклероз, диабет 2-го типа и др.) [50]. Эти данные позволяют говорить о близкой тесной связи метаболической и иммунной систем таким образом, что адекватная функция одной системы находится в выраженной зависимости от другой. Обе системы являются важным гомеостатическим механизмом, нарушения которого приводят к целому ряду тяжелых метаболических заболеваний, включая ожирение, диабет 2-го типа и сердечно-сосудистые заболевания [51].
Омега-3 жирные кислоты регулируют экспрессию генов в различных тканях и органах, включая адипоциты, лимфоциты, уменьшая при этом активность воспаления и улучшая метаболические показатели в виде снижения уровня триглицеридов в сыворотке крови и улучшения эндотелиальной функции [52].
Таким образом, учитывая программирующее влияние факторов питания на экспрессию генома, метаболизм и иммунитет, профилактика хронических неинфекционных заболеваний у детей и взрослых должна начинаться с антенатального периода и включать грамотное назначение питания беременной женщине, с особым контролем за беременными с избыточным весом, ожирением, диабетом. На первом году жизни ребенка необходимы охрана и поддержка грудного вскармливания, учитывая многочисленные научные данные о его положительном влиянии на показатели здоровья ребенка, в т.ч. и в отдаленной перспективе. При невозможности грудного вскармливания следует выбирать ДМС с наименьшим количеством белка, что обеспечивает снижение риска развития ожирения. ДМС должны содержать пробиотики с доказанным положительным действием на показатели здоровья, ДПНЖК и весь набор необходимых микроэлементов и витаминов.
Реально ли создание таких ДМС? Если оптимизация витаминно-минерального комплекса и включение в состав смеси пробиотиков с доказанной эффективностью (B. lactis) стали привычной практикой производства ДМС Nestle, то снижение уровня белка в продукте оказалось сложной задачей, так как требует специального подбора белкового ингредиента. После нескольких лет исследований эта работа была успешно завершена, а ее технология запатентована в научно-исследовательском центре компании Nestle. В результате был разработан новый белковый компонент с оптимизированным аминокислотным профилем (OPTIPRO®), применение которого позволило максимально приблизить белковый компонент смеси по количеству и качеству к белкам ГМ.
Таким образом, данные современных исследований по метаболическому программированию доказывают, что питание на ранних этапах развития (согласно современным данным – в первые 1000 дней жизни) является эффективным фактором профилактики здоровья.
1. Yee J, Lee W, Ross M, et al. Peroxisome proliferatoractivated receptor gamma modulation and lipogenic response in adipocytes of small-for-gestational age offspring. Nutr. & Metab. 2012; 9: 62–73.
2. Joss-Moor L, Wang Y, Campbell M, et al. Uteroplacental insufficiency increases adiposity and visceral adipose PPARγ expression in male rat offspring prior to the onset of obesity. Early Hum. Dev. 2010; 86 (3): 179–185.
3. Hales CN, Barker DJN. The thrifty phenotype hypotesis. BMJ. 2001; 60: 5–20.
4. Verduci E, Banderali G, Barberi S, Radaelli J, et al. Epigenetic effects of human breast milk. Nutrients. 2014; 6: 1711–1724.
5. Alaweed M, Hartmann P, Geldes D, et al. MicroRNAs in breastmilk and the lactating breast: Potential immunoprotectors and developmental regulators for the infant and mother. Int. J. Environ. Res. Public Health. 2015; 12: 13981–14020.
6. Pieters B, Arntz O, Bennink M, et al. Commercial cow milk contains physically stable extracellular vesicles expressing immunoregulatory TGFβ. PLOS ONE. 2015; doi:10.1371/ journal.pone.0121123
7. Toyomizu M, Kimura S, Hayashi K, et al. Body protein and energy accretion in response to dietary protein level in mice from weaning to maturity. J. Nutr. 1989; 119: 1028–1033.
8. Butte NF, Wong WW, Hopkinson JM, et al. Infant feeding mode affects early growth and body composition. Pediatrics. 2000; 106: 1355–1366.
9. Ekelund U, Ong K, Linne Y, et al. Association of weight gain in infancy and early childhood with metabolic risk in young adults. J. Clin. Endocronol. Metab. 2007; 92: 98–103.
10. Leunissen R, Kerkhof G, Hokken-Koelega A. Timing and tempo of first-year rapid growth in relation to cardiovascular and metabolic risk profile in early adulthood. JAMA. 2009; 301 (21): 2234–2242.
11. Denerath EW, Reed D, Choh AC, et al. Rapid postnatal weight gain and visceral adiposity in adulthood: the Fels Longitudinal Study. Obesity. 2009; 17: 2060–2066.
12. Skilton M, Marks G, Ayer J, et al. Weight gain in infancy and vascular risk factors in later childhood. Pediatrics. 2013; 131: e1821–e1828.
13. Habbout A, Li N, Rochette L, et al. Postnatal overfeeding in rodents by litter size reduction induces major short- and long-term pathophysiological consequences. The J. Nutrition. 2013; 143: 553–562.
14. Weber M, Grote V, Closa-Monasterolo R, Koletzko B, von Kries R, Closa R Grusfeld D, Socha P, Dain E. Lower protein content in infant formula reduces BMI and obesity risk at school age: follow-on of randomized trial. AJCN. 2014; 99: 1041–1051.
15. Nair S, Short R. Hormonal and signaling role of branched-chain amino acids. J. Nutr. 2005; 135 (6): 1547S–1552S.
16. Smith PJ, Wise LS, Berkowitz R. Insulin-like growth factor-1 is an essential regulator of the differentiation of 3TrL1 adipocyte. The J. of Biol. Chem. 1988; 263: 9402–9408.
17. Lamkjaer A, Mlgaard C, Mickaelsen K. Early nutrition impact on the insulin-like growth factor axis and later health consequences. Curr. Opin. Nutr. Metabol. Care. 2012; 15: 285–292.
18. Camacho-Hubner C. Normal physiology of growth hormone and insulin-like growth factors in childhood. NCBI Bookshelf, 2010. www.ncbi.nlm.nih.gov/books/NBK279164
19. Gunter A, Walz H, Kroke A, et al. Breastfeeding and its prospective association with components of the GH-IGFaxis, insulin resistance and body adiposity measures in young adulthood – insights from linear and quantile regression analysis. PLOS ONE. 2013; 8 (11): e79436–79446.
20. Bar-Pelоd L, Sabatini M. Regulation of mTORC1 by aminoacid. Trends Cell Biol. 2014; 24 (7): 400–406.
21. Melnik B. Excessive leucine-mTORC1 signalling of cow milk-based infant formula: the missing link to understand early childhood obesity. J. of Obesity. 2012; 2012: 197653. doi: 10.1155/2012/197653.
22. Melnik B. The pathogenic riole of persistent milk sugnalling in mTORC1 – and milk microRNA-driven type 2 diabetes mellitus. Current Diabetes Rev. 2015; 11: 46–62.
23. Xu X, Ye L, Araki K, et al. mTOR, linking metabolism and immunity. Semin. Immunol. 2012; 24 (6): 429–435.
24. Cobbold S. The mTOR path way and integrating immune regulation. Immunology. 2013; 140: 391–398.
25. Paul Y, Camera L, Zeiger R, et al. Realltioship between infant weight gain and layer asthma. Pediatr. Allergy Immunol. 2010; 21 (1): 82–89.
26. den Dekker HT, Sonnenschein-van der Voort AM, de Jongste JC, et al. Early growth characteristics and the risk of reduced lung function and asthma: A meta-analysis of 25,000 children. J. Allergy Clin. Immunol. 2015; 5. pii: S0091- 6749(15)01361-5. doi: 10.1016/j.jaci.2015.08.050.
27. Wopereis H, Oozeer R, Knipping R, Belzer C, Knol J. The first thousand days – intestinal microbiology of early life: establishing a symbiosis. Ped. Allergy and Immunol. 2014; 25: 428–438.
28. Houghteling P, Walker W. Why is initial bacterial colonization of the intestine important to infants and children’s health? JPGN. 2015; 3: 294–307.
29. Satokari R, Laitinen K, Salminen S, et al. Bifidobacterium and Lactobacillus DNA in the human placenta. Letters in Appl. Microbiol. 2009; 48 (4): 8–12.
30. Bode L, McGuirr M, Rodreiguez M, et al. It’s Alive: Microbes and Cells in Human Milk and Their Potential Benefits to Mother and Infant. Advances in Nutr. 2014; 5 (5): 571–573.
31. Collado MC. Effect of mother’s weight on infant’s microbiota acquisition, composition, and activity during pregnancy: a prospective follow-up study initiated in early pregnancy. Am. J. Clin. Nutr. 2010; 92: 1023–1030.
32. Santacruz A, Collado M, Garcia-Valdes L, et al. Gut microbiota composition is associated with body weight, weight gain and biochemical parameters in pregnant women. Br. J. Nutrition. 2010; 104: 83–92.
33. Kalliomaki M, Collado C, Salminen S, et al. Early differences in fecal microbiota composition in children may predict overweight. Am. J. Clin. Nutr. 2008; 87: 534–538.
34. Cabrera-Rubio R, Collado M, Laitinen K, et al. The human milk microbiom changes over lactation and is shaped by maternal weight and mode of delivery. AJCN. 2012; 96: 544–551.
35. Miettinen R, Hermansson H, Gissler M, et al. Mode of delivery – impact on risk of noncommunicable diseases. J. All. Clin. Immunol. 2015; 136 (5): 1398–1399.
36. Tojo R, Suarez A, Clemente V, et al. Intestinal microbiota in health and disease: role of bifidobacteria in gut homeostasis. World J. of Gastroent. 2014; 20 (31): 15163–15076.
37. Klessen B, Bunke H, Tovar K, et al. Influence of two infant formulas and human milk on the development of the fecal flora in newborn infants. Acta Ped. 1995; 84: 1346–1356.
38. Rogier E, Frantz A, Bruno M, et al. Lessons from mother: long-term impact of antibodies in breast milk on the gut microbiota and intestinal immune system of breastfed offspring. Gut. Microbe. 2014; 5: 663–668.
39. Nylund L, Satokari R, Nikkila J, et al. Microarray anslysis reveals marked infant microbiota abberency in infnats having eczema compared to healthy children at risk for atopic disease. BMC Microbiol. 2013; 13: 12. doi: 10.1186/1471-2180- 13-12
40. Kuitunen M, Kukkonen K, Juntene-Backman T, et al. Probiotcs prevent IgE-associated allergy until age 5 years in caesarian-delivered children, but not in the total cohort. J. All. Clin. Immunol. 2009; 123: 335–341.
41. Rautava S, Kalliomaki M, Isolauri E, et al. Probiotics during pregnancy and breast-feeding might confer immunomodulatory protection against atopic disease in the infant. J. All. Clin. Immunol. 2002; 109: 119–121.
42. Abrahamsson T, Jacobsson T, Botttcher М, et al. Probiotics in prevention IgE-associated eczema: A double-blind randomized, placebo-controlled trial. J. All. Alin. Immunol. 2007; 119: 185–191.
43. Rautava S, Kainonen E, Salminen S, et al. Maternal probiotic supplementation during pregnancy and breast-feeding reduces the risk of eczema in the infant. J. All. Clin. Immunol. 2012; 130: 1355–1361.
44. Kalliomaki M, Antoine J, Herz U, et al. Guidance for substantiating the evidence for beneficial effects of probiotics: prevention and management of allergic disease by probiotics. J. of Nutr. 2010; 140: 713S–721S.
45. Yan F, Cao H, Cover T, et al. Soluble proteins produced by probiotic bacteria regulate intestinal epithelial cell survival and growth. Gastoenterol. 2007; 132 (2): 562–575.
46. Rijkers G, Bengmark S, Enck P, et al. Guidance for substantiating the evidence for beneficial effects of probiotics: current status and recommendations for future research. J. Nutr. 2010; 140: 671S–676S.
47. Licciardi P, Wong S, Tang M, et al. Epigenome targeting by probiotic metabolites. Gut. Pathogens. 2010; 2: 24–29.
48. Gani O. Are fish oil omega-3 long chain fatty acids and their derivatives peroxisome proliferator-activated receptor agonists. Cardiovasc. Diabetol. 2008; 7: 6–12.
49. Tyagi S, Gupta P, Saini A, et al. The peroxisome proliferator-activated receptor: a family of nuclear receptors role in various diseases. J. Adv. Pharm. Thechnol. Res. 2011; 2 (4): 236–240.
50. Bowens M, van de Rest, Dellschaft N, et al. Fish-oil supplementation induces anti-inflammatory gene expression profiles in human blood mononuclear cells. AJCN. 2009; 90: 4150424.
51. Hotamisligi G. Inflammation and metabolic disorders. Nature Insight. 2006; 444 (7121): 860–867.
52. Gillies P, Bhatia S, Belcher L, et al. Regulation of inflammatory and lipid metabolism genes by eicosapentaenoic acid-rich oil. J. of Lipid Res. 2012; 53: 1679–1689.
53. Kalliomaki M, Salminen S, Poussa T, et al. Probiotics during the 7 years of life: a cumulative risk reduction of eczema in a randomized, placebo-controlled trial. J. All. Clin. Immunol. 2007; 119 (4): 1019–1021.
Наш сайт в формате приложения всегда под рукой!
Нажмите на кнопку ниже и запустите установку приложения на следующей странице. При первом входе приложение запросит у вас разрешение на уведомления. Пожалуйста, нажмите «Да», если разрешаете приложению Nestle Baby&me Medical отправлять рекламные и информационные уведомления.
НачатьПриложение запросит у вас разрешение на уведомления. Пожалуйста, нажмите «Да», если разрешаете приложению Nestle Baby&me Medical отправлять рекламные и информационные уведомления.
Хорошо- 1. Нажмите на значок «Поделиться», он находится рядом с адресной строкой.
- 2. Выберите «Добавить на главный экран» и нажмите «Добавить».
ЭКСКЛЮЗИВ!
Новика Г.А. и Макаровой С.Г.